Klonování PCR produktu
Princip
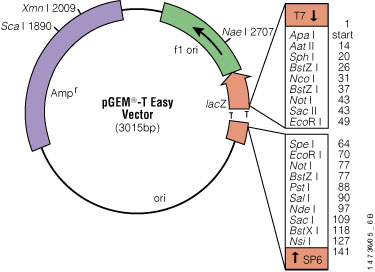
P-GEM-T Easy Vector System I firmy Promega (obsahující plazmid pGEM-T (viz obr.), T4 DNA ligázu, 2 x konc. ligační pufr a kontrolní inzert) je systém vhodný pro klonování PCR produktů. Tento vektor obsahuje poly-T přesahy v klonovacím místě. Tyto přesahy jsou kompatibilní vůči A-přesahům, které vytváří většina termostabilních polymeráz během PCR. Zvyšuje se tak účinnost ligace PCR produktu do plazmidu a je umožněno klonování PCR produktů. Vlastní pGEM-T vektor nese i gen rezistence vůči ampicilinu (Amp), který umožňuje přímou selekci transformovaných bakterií. V klonovacím místě leží gen kódující část enzymu ß-galaktosidasy (ß-Gal), LacZ ?-peptid. Vložením PCR produktu do této oblasti, tzv. inzerční inaktivací LacZ ?-peptidu je porušena produkce ?-peptidu a ß-Gal se stává neaktivní. To umožňuje přímou selekci rekombinantních klonů na základě barevného skríninku na selekčních miskách (tzv. modro-bílá selekce). Na miskách je přítomen substrát pro ß-Gal, X-Gal, který je v případě aktivní ß-Gal (nedošlo k inzerci PCR produktu) přeměněn na nerozpustný modrý produkt (modré kolonie).
Mnohonásobná klonovací oblast nese množství restrikčních míst, které umožňují uvolnění insertu pomocí štípání jednotlivými restrikčními enzymy, klonovaní místo je ohraničeno restrikčními místy rozeznávanými enzymem BstZI.
Obr. P-GEM-T Easy Vector.
PCR amplifikace
Viz obecný protokol k PCR.
Elektroforéza
Kontrola na 1,5% agarosovém gelu, naneseme 1 µl LB + 3 µl vzorku, 3 µl 100 bp ladderu.
Purifikace
Standardním postupem pomocí JetQuick PCR purifikačního kitu.
Pozn.: Pro získání co nejvyšší koncentrace DNA je vhodná tzv. „dvojitá“ eluce 30 µl elučního pufru předehřátého na 65°C, kdy první eluát po centrifugaci naneseme opět na kolonku, necháme 10 - 15 min inkubovat a opět centrifugujeme.
Měření koncentrace DNA
Standardním postupem pomocí spektrofotometru Biowave II.
Ligace
Postup
- Výpočet množství DNA do ligační reakce.
Př.: 800 bp dlouhý klonovaný úsek; pGEM- T Easy Vector (Promega), 50 ng/µl. (50 ng vektoru × velikost inzertu [kb]/3,0 kb vektor) × 3/1 50×0,8/3×3/1= 40 ng insertu na celou reakci, tj. 10 ng na 1/4 reakci, 20 ng na 1/2 reakci
- Pracujeme ve Flow Boxu.
- Připravíme ligační směs pro příslušný počet vzorků + rezerva.
- Směs jemně promícháme špičkou, stočíme a rozpipetujeme.
- Přidáme PCR produkt.
- Inkubujeme přes noc v ledničce při 4°C (možno i 1h při pokojové teplotě, ale je pak nižší účinnost ligace).
Příprava ligační směsi
| chemikálie | 1/4 reakce | 1/2 reakce |
|---|---|---|
| 2x ligační pufr (zvortexovaný!) | 1,25 | 2,5 |
| ligáza (nevyndávat z ledu!) | 0,25 | 0,5 |
| pGEM –T Easy Vector | 0,25 | 0,5 |
| Inzert (PCR produkt) | nutné spočítat – viz výše | nutné spočítat – viz výše |
| Sterilní H2O | doplnit do 2,5 µl | doplnit do 5 µl |
| celkem | 2,5 µl | 5 µl |
Transformace
Postup- Rozmrazíme alikvot 200 µl kompetentních buněk E. Coli, kmen K12, mod. DH? (na ledu!).
- Smícháme 50 µl kompetentních buněk s 2,5 µl ligační směsi v 1,5 ml eppendorfce, inkubujeme 20 min na ledu (dochází ke stabilizaci směsi). Pozn.: Zbytek ligační směsi je možné zamrazit a použít na případné opakování.
- Transformujeme pomocí teplotního šoku: inkubujeme 45 s při 42°C (DryBlock), poté ihned umístíme na led po dobu minimálně 2 min. Netřepat!
Kultivace
Postup- Přidáme 950 µl SOC média (pokojová teplota).
- Inkubujeme na třepačce po dobu 1,5 h při teplotě 37°C, 150 rpm (obnova buněčné stěny, aktivace fyziologických pochodů baktérie, aktivace exprese genů).
- Připravíme kultivační misky s LB/Amp/IPTG/X-Gal: Rozehřejeme tuhé LB médium na míchačce, ve Flow Boxu přidáme ze zásobního roztoku Amp do konečné koncentrace 100 µg/ml kultivačního média. Teplota média nesmí být vyšší 65°C. Do 0,25 l LB média pipetujeme 250 µl zásobního roztoku Amp (0,1g/ml). Médium rozlijeme do misek (cca 25 ml do Petriho misky o průměru 8cm).
- V 1,5 ml sterilní eppendorfce smísíme 64 ul X-Gal (12,5 mg/ml) a 3,5 µl IPTG (240 mg/ml) ze zásobního roztoku, promícháme a naneseme na povrch tuhého média a pomocí sterilní skleněné kultivační kličky rovnoměrně rozetřeme na povrchu média.
- Naneseme 75 µl suspenzní kultury transformovaných bakteriálních buněk a rovněž rozetřeme.
Pozn.: Eventuelně zakoncentrujeme centrifugací po dobu 2 min při 5000 ×g. Odpipetujeme cca 850 µl supernatantu, sediment pipetováním resuspendujeme ve zbytku SOC média (cca 50 µl). Resuspendované buňky přepipetujte na povrch LB/Amp/IPTG/X-Gal média a rozetřete rovnoměrně kličkou.
- Inkubujeme při teplotě 37°C přes noc v termostatu (misky obrácené dnem vzhůru).
- Následující den vyhodnotíme kolonie.
Takto kultivované bakterie jsou vhodné pro přípravu bakteriálních konzerv nebo pro další manipulace a analýzy, především pak izolaci plazmidu či přímou PCR.
Bakterie narostlé na povrchu LB/Amp média je možné uchovávat po dobu max. 1 týdne při teplotě 4°C.
Přímá PCR
Postup- Pracujeme ve Flow Boxu.
- Sterilním párátkem píchneme do samostatné kolonie a párátko vložíme do 1,5 ml eppendorfky s 20 µl sterilní vody. Takto odebereme 10-15 kolonií.
- Zkumavky inkubujeme při 94°C 5 minut v termobloku. Do PCR reakce používáme 1 µl. Zbytek zamrazíme pro případné další použití.
- Provedeme PCR podle obvyklého protokolu.
Likvidace GMO
Použitá párátka vhazujeme do roztoku Sava. Párátka, použité špičky, zbylé suspenzní bakteriální kultury a misky s koloniemi klávujeme v klávovacích pytlích.
Archivace o nakládání s GMO
Vyplníme formulář a vyhotovíme protokol o průběhu celého experimentu. Tyto dokumenty uchováváme po dobu 10 let jak v elektronické, tak papírové podobě.
Na začátek >>